27/10/2021 - 20:16
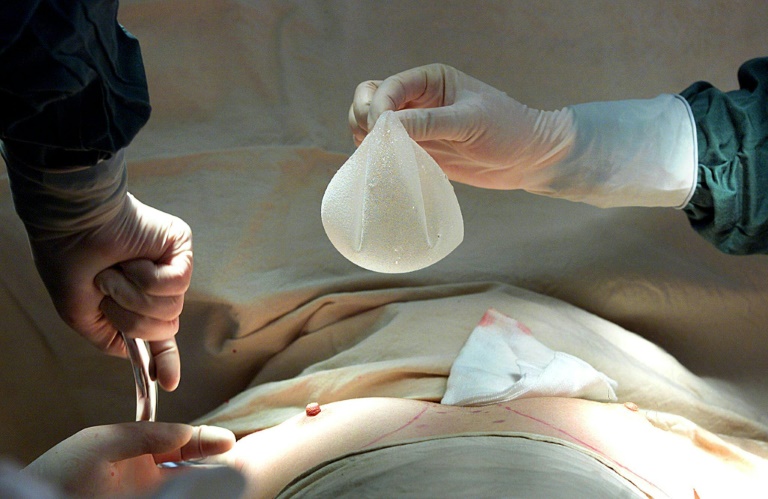
A agência reguladora de alimentos e medicamentos dos Estados Unidos, conhecida pela sigla FDA, aumentou nesta quarta-feira (27) os requisitos para a regulamentação do uso de implantes mamários no país.
Agora, os pacientes deverão receber mais informações de segurança e revisar uma lista de exames com os médicos antes da cirurgia.
A medida é uma resposta às queixas por uma afecção conhecida como “doença do silicone” (BII, na sigla em inglês), cujos sintomas incluem dor articular e muscular, fadiga e confusão mental, e que podem estar relacionados a uma reação imunológica contra os implantes.
“Proteger a saúde dos pacientes quando estes são tratados com um dispositivo médico é nossa prioridade mais importante”, disse Binita Ashar, diretora da Divisão de Dispositivos Cirúrgicos da FDA.
“Ao aumentar os requisitos de segurança para os fabricantes, a FDA está trabalhando para fechar as lacunas de informação para qualquer um que esteja considerando a cirurgia de implantes mamários”, acrescentou.
A agência vem analisando o tema da “doença do silicone” desde 2019, incluindo o possível vínculo entre os implantes e um câncer conhecido como linfoma anaplásico de células grandes (BIA-ALCL), que, no entanto, é pouco comum e registrou apenas 733 casos entre dezenas de milhares de cirurgias realizadas por ano.
Agora, as próteses devem conter etiquetas de advertência atualizadas e os cirurgiões terão que fazer um série de exames e verificações com seus pacientes, o que inclui informá-los que “os implantes não são considerados dispositivos permanentes”.
Eles também deverão ser informados sobre as possíveis complicações, desde as mais comuns como dor nos seios, sensibilidade da pele e dos mamilos, assimetria, até as mais raras, como necrose dos tecidos, dor crônica e incapacidade para amamentar.
Também se recomenda que, no caso dos implantes de silicone, os pacientes façam uma primeira ressonância magnética depois de cinco ou seis anos do procedimento e, após isso, a cada dois ou três anos.